
Para reacciones de primer- orden, la vida media es una constante que depende solo de la constante de velocidad , k, y no de la concentración de los reactivos
Si k es conocida, t½ puede ser calculado, y si t½ es conocido, k puede ser calculada
Aplicaciones comunes de la vida media es el calculo de la radioactividad de los isótopos , – ej., medicina, energia nuclear etc.
Vida media de la reacción

Reacción de segundo orden
La reacción de segundo orden tienen una ley de velocidad donde la suma de los exponentes es igual a 2
v= k[A]m[B]n m + n = 2
v= k[A]2 m = 2
La expresión de la ley de velocidad integrada donde se expresa [A] en función del tiempo tiene la siguiente forma
1/[A]t = kt + 1/[A]o

t1/2= 1/ [NO2]0 k
2NO2 (g) ?? 2 NO (g) + O2 (g)
1/ [ NO2 ] t =1/ [NO2 ]0 + k. t
k = M-1 s-1
Reacciones de segundo orden
(Gp:) – d[NO2] 2
dt
(Gp:) v =
(Gp:) = k [NO2] 2
1/ [NO2] (M-1)
Tiempo (s)

Resumen
(Gp:) Velocidad= k
(Gp:) Velocidad= k [A]
(Gp:) Velocidad= k [A]2
(Gp:) – pendiente
(Gp:) – pendiente
(Gp:) pendiente
(Gp:) Orden Ley de velocidad Ecuación integrada Grafico k Unidades Vida
de k media

Modelos teóricos de la cinética química
La teoría cinético-molecular permite calcular la frecuencia de colisión.
En una reacción típica entre gases, la frecuencia de colisión es del orden de 1030 colisiones por segundo.
Si en cada colisión se obtuviesen moléculas de producto, la velocidad de reacción sería aproximadamente 106 M s-1.
Las reacciones reales tiene una velocidad del orden de 104 M s-1. Ésta sigue siendo una velocidad muy rápida.
Sólamente una fracción de las colisiones dan lugar a reacción química.
Teoría de colisiones

Energía de activación
Para que una colisión entre moléculas vaya seguida de una reacción, debe haber una redistribución de energía, de manera que haya energía suficiente en ciertos enlaces clave que deben romperse.

Energía de activación
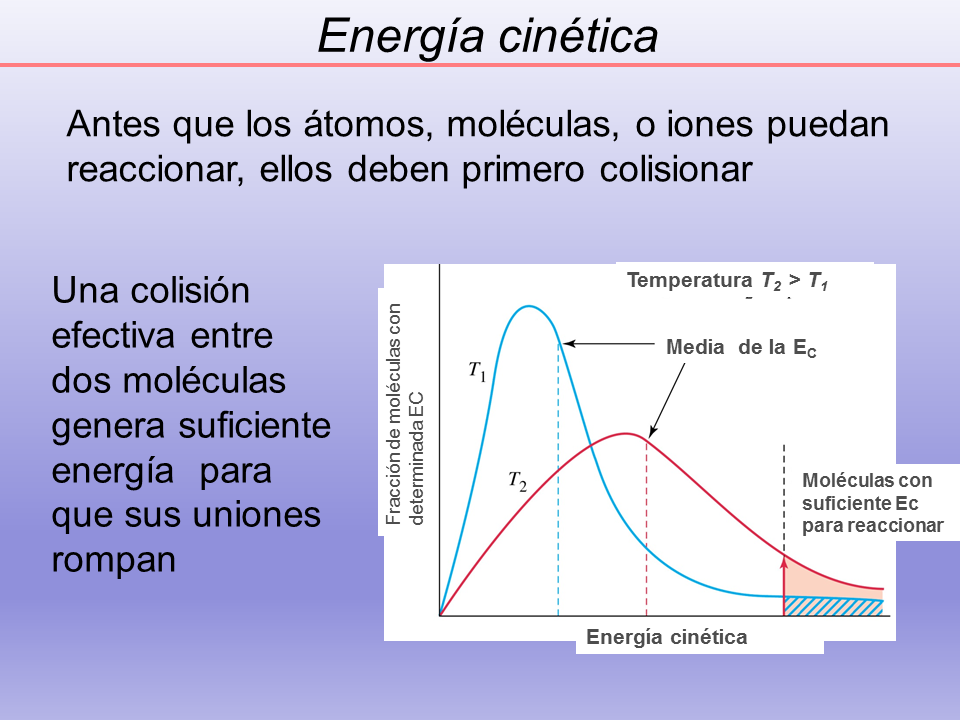
Energía cinética
Antes que los átomos, moléculas, o iones puedan reaccionar, ellos deben primero colisionar
Una colisión efectiva entre dos moléculas genera suficiente energía para que sus uniones rompan
Media de la EC
Moléculas con suficiente Ec para reaccionar
Energía cinética
Fracción de moléculas con determinada EC
Temperatura T2 > T1

Teoría de las colisiones
La energía de activación (Ea) es la energía mínima, superior a la energía cinética media, que deben tener las moléculas cuando chocan para que tenga lugar una reacción química.
Si la barrera de activación es elevada, sólo algunas moléculas tendrán suficiente energía cinética y la reacción es más lenta.
A medida que la temperatura aumenta, la velocidad de reacción también aumenta.

Teoría de colisiones
(Gp:) (a) Colisión favorable
(Gp:) (b) Colisiones no favorables
La orientación de las moléculas puede ser importante. La orientación espacial de las especies que colisionan también afecta la velocidad de reacción.

Teoría del estado de transición
El complejo activado es una especie hipotética que se encuentra entre los reactivos y los productos en un punto sobre el perfil de una reacción denominado estado de transición.

Teoría del estado de transición
La configuración de los átomos en el tiempo de la colisión es llamado el estado de transición
Las especies transitorias tienen la configuración que es llamada de complejo activado
Energía de activación
(Gp:) Progreso de la reacción
(Gp:) Energía potencial (kJ)
(Gp:) Ea(directa)=134 kJ
(Gp:) Ea(inversa )=360 kJ
(Gp:) Complejo activado
(Gp:) Reactivos
(Gp:) Productos
(Gp:) Calor de la reacción (?H)

Efecto de la temperatura
(Gp:) Altamente sensible a la temperatura
(Gp:) Altamente sensible a la temperatura
(Gp:) Reacción endotérmica Reacción exotérmica
(Gp:) Progreso de la reacción
(Gp:) Progreso de la reacción
(Gp:) Energía potencial
(Gp:) Energía potencial
? H = +
? H = –

(Gp:) Concentraciones
de los reactivos
(Gp:) Area
superficial
(Gp:) Catalizador:
Velocidad
(Gp:) Temperatura
Factores de lo que depende la velocidad

Dependecia de la velocidad de reacción con la temperatura
En1889, Svante Arrhenius demostró que las constantes de velocidad de muchas reacciones varían con la temperatura según la expresión:
k = Ae-Ea/RT
La constante A, es llamada factor de frecuencia, es el producto de la frecuencia de las colisiones y el factor de probabilidad que tiene en cuenta la orientación requerida para que sea efectiva la colisión molecular .
La expresión e–Ea/RT representa la fracción de moléculas que tiene suficiente energía para colisionar y producir la reacción.

Representación gráfica de Arrhenius
N2O5(CCl4) ? N2O4(CCl4) + ½ O2(g)
(Gp:) = -1,2×104 K
(Gp:) R
(Gp:) -Ea
Ea = 1,0×102 kJ mol-1
(Gp:) ln k = + ln A
(Gp:) R
(Gp:) -Ea
(Gp:) T
(Gp:) 1
k = Ae-Ea/RT

Ecuación de Arrhenius
k = Ae-Ea/RT
(Gp:) ln k = + ln A
(Gp:) R
(Gp:) -Ea
(Gp:) T
(Gp:) 1
(Gp:) ln k2– ln k1 = + ln A – – ln A
(Gp:) R
(Gp:) -Ea
(Gp:) T2
(Gp:) 1
(Gp:) R
(Gp:) -Ea
(Gp:) T1
(Gp:) 1
(Gp:) ln = –
(Gp:) R
(Gp:) -Ea
(Gp:) T2
(Gp:) 1
(Gp:) k2
(Gp:) k1
(Gp:) T1
(Gp:) 1
(Gp:) Ea > 60 kJ/ mol ? la reacción depende fuertemente de la temperatura.
(Gp:) Ea ? 10 kJ/ mol? la reacción depende ligeramente de la temperatura.

(Gp:) Concentraciones
de los reactivos
(Gp:) Area
superficial
(Gp:) Catalizador:
Velocidad
(Gp:) Temperatura
Factores de lo que depende la velocidad
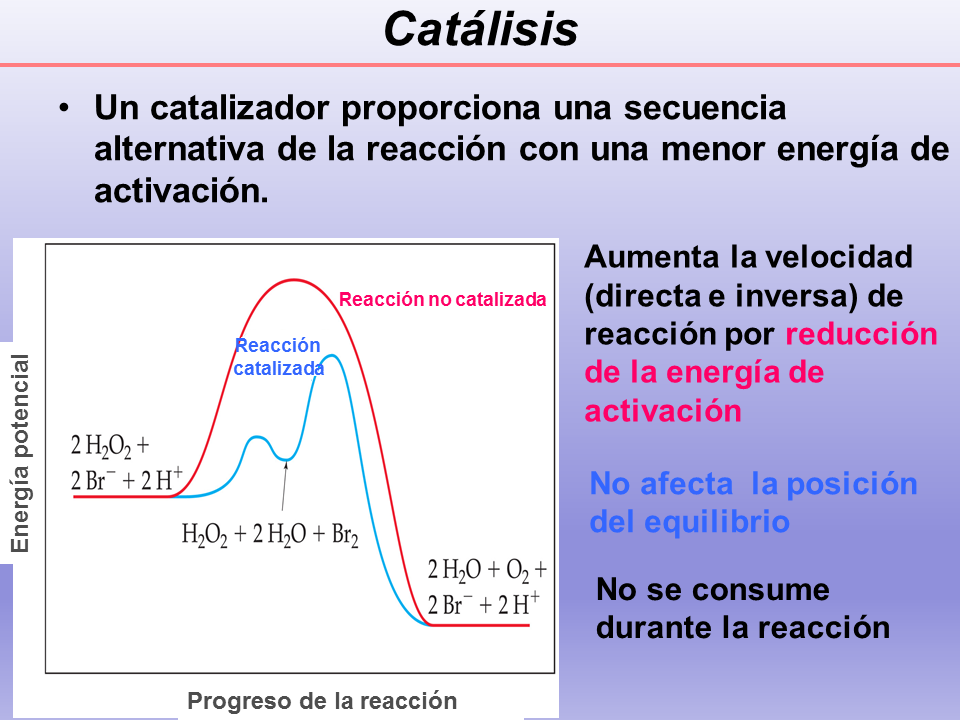
Catálisis
Un catalizador proporciona una secuencia alternativa de la reacción con una menor energía de activación.
(Gp:) Progreso de la reacción
(Gp:) Energía potencial
(Gp:) Reacción no catalizada
(Gp:) Reacción
catalizada
Aumenta la velocidad (directa e inversa) de reacción por reducción de la energía de activación
No afecta la posición del equilibrio
No se consume durante la reacción

Catálisis homogénea
Todas las especies de la reacción están en disolución.
(Gp:) Progreso de la reacción
Energía potencial
Reaccion no catalizada
Reaccion catalizada

Catálisis heterogénea:
El catalizador está en el estado sólido.
Los reactivos de una fase gaseosa o líquida son absorbidos.
Las posiciones activas sobre la superficie catalítica son importantes.

Mecanismos de reacción
Una descripción detallada de una reacción química.El mecanismo de reacción es una serie de simples pasos que a lo largo del tiempo llevan desde las reactivos iniciales a los productos finales de la reacción
Cada paso se denomina reacción elemental:
Transformación molecular que modifica de forma importante la energía o geometría de una molécula o produce una o más nuevas moléculas.
Un mecanismo de reacción debe:
Ser consistente con la estequiometría de la reacción global.
Dar cuenta de la ecuación de velocidad determinada experimentalmente.El mecanismo debe explicarse por las determinaciones experimentales de la ley de velocidad

Reacción elemental
La molecularidad en una reacción elemental se refiere al numero de átomos libres, iones o moléculas que participan como reactivo en la reacción elemental.

Reaccion elemental
Los exponentes de los términos de concentración son los mismos que los coeficientes estequiométricos de la ecuación ajustada del proceso.
Los procesos elementales son reversibles.
Los intermedios se producen en un proceso elemental y se consumen en otro.
Un proceso elemental puede transcurrir mucho más lentamente que todos los demás y se conoce como etapa determinante de la velocidad.

Mecanismo de reaccion
En el caso en que ocurra en más de una etapa, debemos considerar la velocidad de la reacción de la etapa más lenta.
Velocidad lenta
Etapa rápida
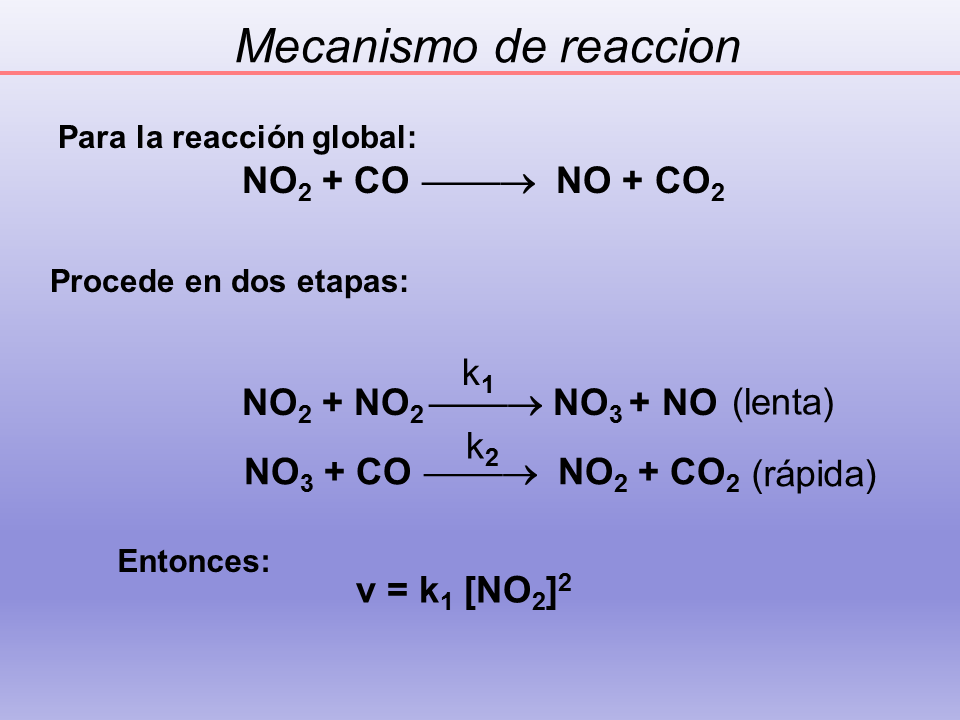
v = k1 [NO2]2
NO2 + CO ??? NO + CO2
(Gp:) NO2 + NO2 ??? NO3 + NO
(Gp:) NO3 + CO ??? NO2 + CO2
(Gp:) (lenta)
(Gp:) (rápida)
Para la reacción global:
Procede en dos etapas:
Entonces:
k1
k2
Mecanismo de reaccion
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |